2014-03-17
org.kosen.entty.User@5322dacc
최규석(seed77)
- 2
합성을 하고 나서 수득율은 어떻게 계산하는건가요?
A + B = C(MW120)
0.1mmol 0.5mmol 5mg
만약 A과 B 을 반응하여 C 0.5g을 얻었습니다.
그럼 이것은 수득률은 몇%인가요?(만약 당량도 계산해야 되고 그럼 분자량은 이미로
바꿔서 설명해주셔도 됩니다.)
한계반응물 0.1mmol X 생성물 120g/mol = 12mg
실제얻은생성물5mg/이론적생성물12mg X 100% = 41.7%
????????????
A + B = C(MW120)
0.1mmol 0.5mmol 5mg
만약 A과 B 을 반응하여 C 0.5g을 얻었습니다.
그럼 이것은 수득률은 몇%인가요?(만약 당량도 계산해야 되고 그럼 분자량은 이미로
바꿔서 설명해주셔도 됩니다.)
한계반응물 0.1mmol X 생성물 120g/mol = 12mg
실제얻은생성물5mg/이론적생성물12mg X 100% = 41.7%
????????????
- 합성
- 수득율
지식의 출발은 질문, 모든 지식의 완성은 답변!
각 분야 한인연구자와 현업 전문가분들의 답변을 기다립니다.
각 분야 한인연구자와 현업 전문가분들의 답변을 기다립니다.
답변 2
-
답변
이배훈님의 답변
2014-03-17- 0
첨부파일
수득률=실제수득량/이론수득량 *100
예
살리실산(3.2g)+무수초산(2.5g)= 아스피린(2.7g)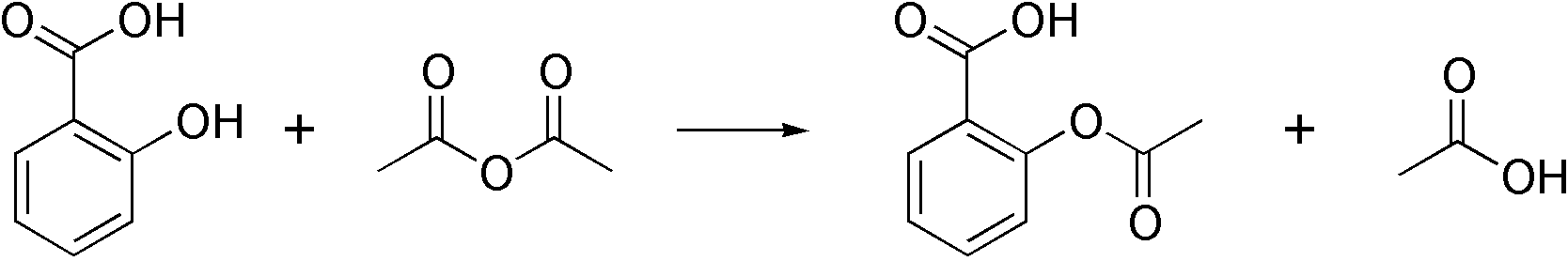
살리실산 3.2g (Mw 102.09g/mole,0.031mole)-excess
무수초산 2.5g (Mw 138.12g/mole, 0.018mole)-한계반응물
아스피린(Mw 180.16g/mole)이 한계반응물(0.018)과 같은 몰이 이론적으로 생성됨
0.018 mole × 180.16 g/mole = 3.24g (이론 수득량)
수득률=실제수득량/이론수득량 *100=2.7/3.24*100=83.3 %
* A와 B=C 반응의 정확한 몰 반응식이 필요함.
A (1g, 0.01mol)+B (1g, 0.02mol) --- C (0.01 mol, 1.2g ) 1.5/1.2*100= 실제수득량/이론수
득량=125% (불가능)
A+B=C 이론 수득 0.01 mol* 120g/mol= 1.2g (c 가 0.01 mol 얻었진다는 가정)
A-B-C에 대한 정확한 화학 반응식이 필요한 것 같네요.
A+2B=3/2C 인경우 (c 가 0.015 mol 얻어짐 0.015 mol*120g/mol=1.8g 이론 수득)
1.5/1.8*100= 83.3 % 수득율
A B C에 정확한 화학식을 이용(당량 반응)
몰계산-이론수득 계산
-
답변
조윤환님의 답변
2014-03-19- 0
반갑습니다.
합성반응의 수득률 계산에 대해 앞서 답변한 분께서 잘 설명 해주셨습니다.
limiting agent를 기준으로 수율을 계산하는 방식을 설명해 주신 것으로 교과서적인 설명입니다.
그리고 마지막에 화학반응의 정확한 몰 반응식이 필요하다고 지적하신 부분도 맞습니다. 하지만 혼동될 수 있는 부분도 있고, 실제로 사용하는 방법과의 작은 괴리감이 있어서 부연 설명을 하고자 합니다.
이는 화학을 접할 때 처음 배우게 되는 화학양론에서 화학반응식의 balancing을 뜻 합니다. 보통 이야기 하는 수득률은 이론적으로 수득 가능한 양과 실제 수득한 양의 백분율 입니다. 즉, 직접 수행한 반응의 화학적 효율을 뜻한다고 생각하시면 되겠습니다.
따라서 수득률은 100%를 넘을 수 없습니다. 효율을 계산하자면 최대효율, 즉 이론적 수율을 알아야 하기 때문에 정확한 화학반응의 balancing이 필요 한 겁니다. 예를 들어 수소와 산소가 반응해서 물이 생성되는 연소반응을 생각해보겠습니다.
H2 + O2 --> H2O 라는 화학식은 정확한 화학 반응식이 아닙니다.
2H2 + O2 --> 2H2O 처럼 계수를 맞추는 balancing을 해야 합니다.
이 화학식에서 H2 또는 O2가 limiting agent가 될 수 있습니다. 서로 혼합한 양에 따라 그때 그때 limiting agent가 바뀔 수 있죠. 때문에 실제로 수율을 계산할 때는 좀 더 관심이 있는 출발물질을 limiting agent로 설정 합니다.
예를 들어 위 화학반응에서는 H2가 limiting agent가 될 가능성이 더 높습니다. 왜냐하면 산소는 비교적 저렴하고, 공기 중에 포함되어 있어서 쉽게 구할 수 있지만 수소는 그렇지 않거든요. 즉 좀 더 비싸거나 반응에서 중요한 역할을 한다거나 하는 출발물질을 기준으로 잡는다는 말씀 입니다.
예를 들어 아스피린 합성 반응의 경우 살리실산은 주재료에 해당하고, acetic anhydride는 부재료로 인식하는 것이 합성하는 사람들의 일반적인 인식입니다. 따라서 acetic anhydride의 당량이 반응의 수율을 결정하는 limiting agent라고 해서 acetic anhydride의 몰 수를 기준으로 수득률을 계산하지는 않는다는 말입니다. 하지만 동일한 반응이지만 14C 동위원소로 표지된 acetic anhydride로 14C 표지된 아스피린을 합성하는 반응이라면 acetic anhydride를 기준으로 수득률을 계산하는 것이 보다 합리적일 겁니다.
그럼 기준이될 limiting agent를 H2로 잡고 수득률 계산을 생각을 해보죠. 위 반응식에서 수소 2몰이 반응을 하면 물 2몰이 생성 됩니다. 따라서 출발물질인 수소의 몰수와 생성물인 물의 몰수의 비는 1:1 입니다. 따라서 수소 1몰을 반응시킬 때 최대로 얻을 수 있는 물의 양은 1몰인 것입니다.
만약 실제 실험에서 0.8몰의 물을 얻었다면 그 실험의 수득률은 1.0/0.8*100 = 80% 입니다. 즉 이 실험의 화학적 효율이 80% 였다는 뜻이 됩니다.
만약 이 처럼 화학식의 balancing에 따른 출발물질과 생성물의 몰 비를 중요하게 고려하지 않으면 2A --> C 같은 화학반응의 경우엔 최대 수득률이 50%가 될수 밖에 없습니다.
이해하시는데 도움이 되었으면 좋겠군요.


