- 2
사산화이질소와 이산화질소의 화학적평형에 대한 실험을 하려고 하는데요
실험한 자료를 보니깐 이산화질소를 피스톤에 넣고 압력을 가하면 색이 변하더라구요.
근데 여기서 무슨 화학적평형이 일어난거죠?화학적평형이 이해가 안되네요.....
또 사산화이질소와는 무슨 연관이 있는거죠? 실험이 다 이산화질소밖에 없던데요.....
연관성을 좀 말해주세요
- 평형
각 분야 한인연구자와 현업 전문가분들의 답변을 기다립니다.
-
답변
김준헌님의 답변
2016-08-30- 2
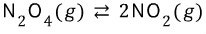 식을 생각해봅시다.
식을 생각해봅시다.르 샤틀리에의 원리란 '평형에 도달해 있는 계에 압력, 온도, 농도 등등 조건을 변화시키면 그 변화를 감소시키는 방향으로 평형이 이동한다.' 라고 알고 계시면 될 것 같습니다.
따라서 위 반응에서 르 샤틀리에 원리에 따르면
피스톤에 압력을 가하면 기체의 몰수가 감소하는 방향으로 반응이 진행됩니다. (역반응 방향)
반대로 압력이 감소하면 기체의 몰수가 증가하는 방향으로 반응이 진행됩니다. (정반응 방향)
이렇게 압력 변화를 주면서 적갈색인 NO2 와 무색인 N2O4가 왔다갔다 하게 되는 것이죠.
추가로, 온도의 변화가 없다면 평형상수는 일정합니다.
평형상수가 변하지 않는 다는 말과, 평형의 위치가 변하지 않는 다는 말을 서로 헷갈리면 안됩니다.
기체의 몰수가 증가하는 방향은 정반응 방향이고, 평형의 위치는 정반응 쪽으로 약간 이동하지만
평형상수는 온도가 일정하므로 변하지 않습니다.
역반응의 경우도 같은 개념입니다.

-
답변
김성수님의 답변
2017-08-25- 1
위 반응에서 르 샤틀리에 원리에 따르면
피스톤에 압력을 가하면 기체의 몰수가 감소하는 방향으로 반응이 진행됩니다. (역반응 방향)
반대로 압력이 감소하면 기체의 몰수가 증가하는 방향으로 반응이 진행됩니다. (정반응 방향)
이렇게 압력 변화를 주면서 적갈색인 NO2 와 무색인 N2O4가 왔다갔다 하게 되는 것이죠.



답변 감사합니다.