Major Research Interests
본 연구실은 생리활성 화합물을 이용하여 생체 내 단백질 및 유전체의 기능을 분석하는 화학유전체학 (chemical genomics) 연구를 통해 국제적으로 경쟁력 있는 유전체기능 연구 (functional genomics) 및 신약개발 기초연구의 수행을 목표로 하고 있다. Chemical genomics 연구는 다양한 질환 및 환경조건에서 나타나는 세포 및 생체 수준의 phenotype 들을 대상으로 연구가 가능하며 그에 따른 실험방법 또한 다양하게 발전되어 왔다. 본 연구실에서 chemical genomics/proteomics를 활용하여 연구하고 있는 phenotype 분석 대상과 실험방법들을 간단히 소개하고자 한다.
1. Phenotype 분석 대상본 연구실은 혈관신생 (angiogenesis), 세포주기조절 (cell cycle regulation) 등 암과 연관되어 나타나는 특이적인 phenotype을 주요 연구 대상으로 삼고 있다. 혈관신생은 암세포의 지속적인 성장에 필수적인 산소와 영양분을 공급하는 새로운 혈관 생성과정으로, 혈관신생 특이적인 새로운 표적단백질의 발굴 및 이에 근거한 조절 약물의 개발은 저독성이고 내성이 없는 항암 치료제 개발의 일환으로써 절실히 요구되는 상황이다. 이 같은 생명현상을 전체 유전체가 기능하는 세포수준에서 검증할 수 있는 분석체계를 구축하고 이를 조절하는 화합물을 확보한 후 그 활성을 생화학, 세포, 분자생물학적으로 검증함으로써 효율적으로 생명기능연구를 수행할 수 있다. 그 결과 최근 본 연구실에서는 혈관신생을 조절하는 새로운 표적단백질로 histone deacetylase (HDAC)와 aminopeptidase N (APN) 등을 발굴하고 이들의 활성을 조절할 수 있는 화합물도 확보하였으며 (Nat. Med.,2001; Chem. Biol., 2003), 현재 이들의 임상적용실험을 진행하고 있다. |
 |
2. 생리활성물질 라이브러리 구축 및 화합물 개량
생리활성물질은 chemical genomics 연구를 위한 필수적인 연구재료이다. 본 연구실은 화학합성을 통한 synthetic library 및 천연물 유래의 natural product library (fungi extract library, medicinal plant library, metabolom library) 등 다양한 source를 통해 생리활성물질을 발굴하고 연구재료로 사용하고 있다. 특히 화학구조의 다양성으로 소재차별화에 유리하고 수백년간 실생활에 활용되어 임상학적 효능이 검증된 천연물라이브러리 구축에 심혈을 기울이고 있다. 아울러 화합물과 표적단백질에 대한 분자적 수준의 정보가 확보되면 화합물의 개량을 위한 의약합성을 수행함으로써 신약개발의 성공률을 증가시키는 연구도 수행하고 있다. |
3. 생리활성물질의 표적단백질 결정 및 작용기전연구현재 생리활성물질의 표적단백질 결정방법은 affinity-selection에 기초한 방법과 yeast genetics에 기초한 표적결정방법으로 나눌 수 있다. 본 연구실은 affinity-selection과 phage display biopanning 방법을 이용하여 생리활성 물질의 표적단백질을 결정하고 있으며, 그 결과 본 연구실에서는 새로운 세포주기 조절물질인 HBC의 표적단백질을 결정하는 등 실질적인 성과를 산출하고 있다 (Chem. Biol., 2004). |
4. Proteomics을 통한 새로운 단백질 및 질병치료를 위한 표적단백질 발굴
Proteomics를 통해 생리활성물질 처리등에 따른 세포생리학적 변화와 관련된 단백질 network의 움직임을 총체적으로 분석함으로써 새로운 기능의 단백질을 발굴하고 질병치료에 유효한 표적단백질을 찾아낸다. 또한 protein microarray를 활용하여 생리활성물질의 표적 단백질 동정이나 단백질 상호 작용분석과 관련된 새로운 연구영역을 개척하고 있다.
5. 향후 연구 방향
본 연구실은 혈관신생 및 세포주기조절 뿐만 아니라 발모조절, 생체 내 항산화 조절기전, autophagy등 다양CI°i 흥미로운 생물학적 phenotype들을 대상으로 chemical genomics 연구범위를 확대하고 있다. 또한 효율적으로 천연물을 고정 화 할 수 있는 photoaffinity based chemical chip에 관한 연구, 이를 활용한 다수의 화합물의 표적단백질 결정 방법 개발 및 고집적 화합물 chip으로서 활용하는 연구도 진행 중에 있다. 향후 생리활성 저분자물질을 활용한 생체 기능연구 및 신약후보물질 개발을 위해 genomics, proteomics, bioinformatics, systems biology등 Omics기술을 지속적으로 응용하여 화학 유전체학 및 단백질체학 분야에서 국제적으로 경쟁력있는 독창적인 연구를 수행할 것이다.
화학유전체학
Background
20세기 후반 미국의 주도로 시작된 휴먼 게놈프로젝트 (Human Genome Project)는 약 30억개에 해당하는 인간 유전체의 염기서열을 결정함으로써 인간생명의 실체를 이해하는 기초의 마련과 질병의 원인분석 및 치료제 개발을 획기적으로 앞당길 수 있는 발판을 확립하게 되었다. 이 같은 인간 유전체 지도의 완성은 기능유전체학 (functional genomics) 시대의 도래를 의미하였다. 그러나 약 3만개 정도로 추정되는 유전자들 각각의 기능을 분석하는 일은 더 많은 시간과 어려움이 뒤따르는 일이며, 이를 위해 최근 수많은 신학문들이 등장하게 되었는데 그 대표적인 예가 화학유전체학 (chemical genomics)이다.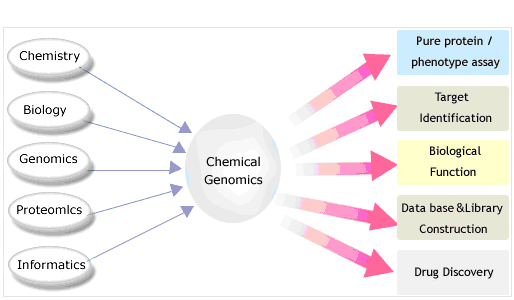
Definition of Chemical genomics
화학유전체학은 분자량 1,000 이하의 저분자 화합물과 최신 유전체학의 개념 및 기술을 사용하여 유전자 기능해석과 신약 개발의 효율성을 극대화하는 새로운 패러다임의 연구 기법이다. 즉, 특정 유전자의 기능을 알아보기 위해선 그 유전자에 대한 화학적 변형을 유발한 특정 돌연변이주를 이용하는 기능유전체학과 달리, 화학유전체학은 유전자의 변형 없이 그 유전자가 생산하는 단백질과 친화도가 높은 화합물을 이용하여 단백질의 기능을 직접 조절함으로써 유전자의 정체 및 기능을 규명 할 수 있다. 이같은 연구결과는 유전자 및 단백질의 기능해석에 있어 새로운 영역 개척에 기여할 수 있으며 또한 저분자 화합물과 이의 표적 단백질에 대한 정보는 독창적 신약개발의 모체가 된다. 최근 화학유전체학은 다양한 생체기능조절을 효율적으로 해석하기위해 genomics 뿐만아니라 proteomics, bioinformatics, systems biology등 다양한 omics개념과 기술이 통합되어 발전하고 있다.Classification
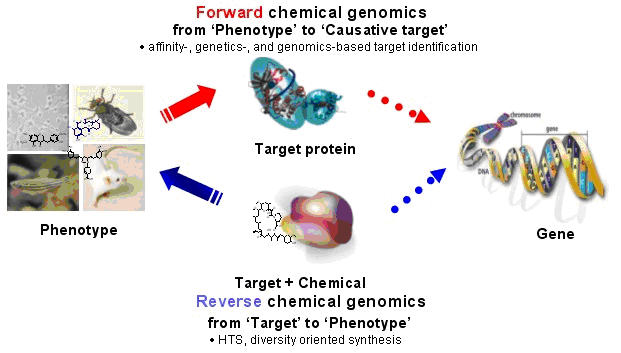
Forward chemical genomics (phenotype→gene) :
특정 질환에 활성을 보이는 생리활성물질의 세포내 표적 단백질을 동정한 후, 그 표적 단백질을 암호화
하는 유전자의 정체를 확인하고, 그 유전자가 특정 phenotype의 결정요인이 됨을 밝혀내는 방식.
Reverse chemical genomics (gene→phenotype) :
특정 유전자에 의해 발현되는 단백질 (표적 단백질)의 기능을 조절할 수 있는 생리활성물질을 HTS 등을
활용하여 대량 확보한 후, 그 중에서 가장 활성이 큰 생리활성물질을 이용하여 phenotype의 변화를 유도
하고, 그 phenotype의 변화가 표적 단백질의 조절에 의해서 나타남을 검증하는 방식.