국제적 저명 학술지인 Nature는 최근 다양한 병원성 진균들이 식품의 안전을 위험하고, 지구상의 여러 동식물 및 각종 생물의 종을 멸종 시키며, 지구 생태계 균형을 전반적으로 교란시키고 위협하고 있다고 보고하였다(Nature, 2012). 특히 지난 수십 년 동안 급속히 증가된 장기이식수술, 항암치료 및 후천성면역결핍증(AIDS) 등에 의해 면역 능력이 저하된 환자들의 경우 Candida, Aspergillus, Cryptococcus 등의 인간 기회감염성 병원성 진균에 의한 감염이 전 세계적으로 지속적인 증가 추세를 보이고 있다. 이러한 병원성 진균은 다양한 자연환경에 존재하여 단지 인간의 건강뿐만 아니라, 축산 및 농수산 비롯하여 환경과 생태학적인 측면에서도 심각한 문제로 대두되고 있다. 이중 Cryptococcus는 주로 전 세계 대부분지역의 해수와 담수, 토양, 나무, 축산동물 및 조류 등의 다양한 자연환경에서 광범위하게 발견되며, 인간에게는 호흡기를 통해 폐감염을 일으킨 후 결국 중추신경계를 통해 뇌수막염을 일으키는 병원성 진균이다. 전 세계적으로 가장 많이 발견되는 Cryptococcus 종은 A-항원형의 C. neoformans var. grubii로써 주로 면역결핍환자들에게 감염을 일으키는 것으로 알려져 있다. 그러나 1999년 캐나다의 British Columbia 지역의 밴쿠버섬 인근 지역에서 시작되어 현재 전염병화 된 B-항원형 Cryptococcus gattii에 의한 뇌수막염은 면역체계에 이상이 없는 일반인들마저도 감염시키는 것으로 밝혀져, 이에 대한 우려가 전 세계적으로 증폭되고 있는 실정이다. 미국 질병통제예방센터의 보고에 따르면 Cryptococcosis는 전 세계적으로 연간 백만 건 이상 발병되고 있으며, 이에 따른 사망률은 60%에 육박하는 것으로 알려져 있다. 이러한 질병의 심각성에도 불구하고 현재 임상적으로 사용되고 있는 항진균제 중 폴리엔(Polyene) 계열의 약물의 경우 독성이 심하고, 아졸(Azole) 경우 약물의 효능 부족과 독성 및 저항성 균주의 출현도가 증가하고 있어서, 부작용이 적으면서 효과적인 활성을 나타내는 약물 개발의 필요성이 증대되고 있다.
한국, 일본, 중국 등지에서도 다수의 연구자들에 의해 자연환경 및 환자의 샘플에서 광범위하게 Cryptococcus 종들이 분리되어 보고 된 바 있으며 (2005년 Cryptococcus and Cryptococcosis, 보스턴 미국), 국내에서는 지난 2007년 3월 27일에 KBS “현장기록병원“에서 방송된 바와 같이 면역성에 전혀 이상이 없는 5세 유아들에게서 폐, 심장 및 기도를 둘러싸고 있는 크립토코쿠스증이 발견되어 감기 및 독감 증상과 유사한 고열을 보고 한바 있어, 한국 및 아시아 지역도 감염 및 전염병 발병의 가능지대로 예측되고 있다. 그럼에도 불구하고 아직 국내에서는 그 정확한 분포도와 발견되는 Cryptococcus 종에 대한 자세한 분석조차 자세히 이루어지고 있지 않은 실정이고, 전 세계적으로도 Cryptococcus의 병원성 조절 메커니즘 및 신호전달체계에 대한 연구는 이제 시작 단계에 불과하며, 따라서 아직 정확한 발병의 원인에 대한 규명, 병원성 조절 신호전달네트워크의 작동기작 규명 및 이를 통한 효과적인 예방 및 치료법이 개발되지 못하고 있는 실정이다.
이러한 난관에도 불구하고 크립토코커스증을 치료하기 위한 전 세계적인 노력의 일환으로 미국과 캐나다의 학`연간의 공동유전체연구(Broad Institute (Harvard대학, MIT대학 공동운영), Duke대학, TIGR 및 University of British Columbia (캐나다))를 통해 현재 4가지 종의 Cryptococcus의 genome sequencing이 완료되어(2005년 Science지, 2014년 PLoS Genetics에 발표), 본격적인 유전체학적 연구가 가능하게 되었다. 또한 지난 10년간 돌연변이균제조법, 벡터시스템 및 Agrobacterium을 이용한 random mutagenesis 방법 등의 다양한 분자생물학적 도구가 개발되어 본격적이고 활발한 분자생물학적, 유전학적, 생리학적, 생화학적 연구가 가능케 되었다.
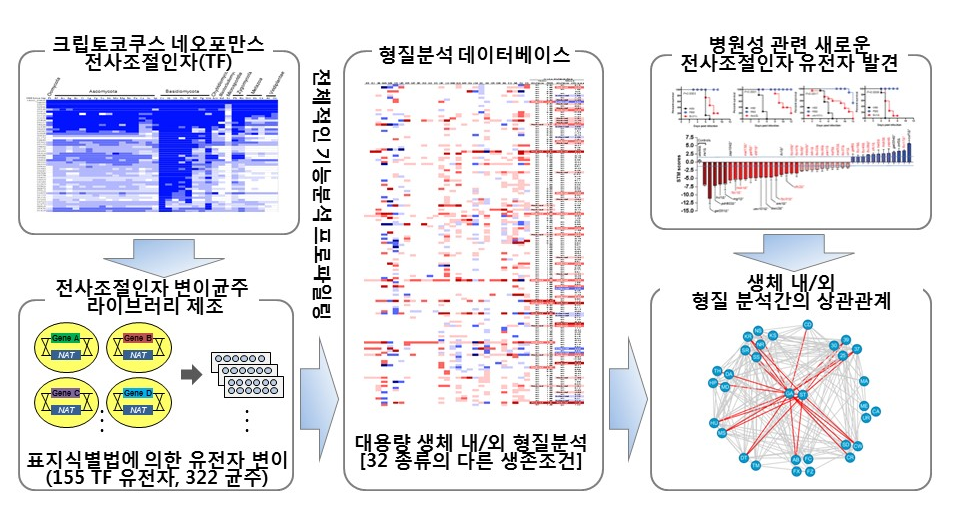
뇌수막염 진균인 크립토코쿠스 네오포만스의 전사조절인자 균주 제조 및 표현형 분석
(Jung, K.-W. et al. Systematic functional profiling of transcription factor networks in Cryptococcus neoformans. Nat. Commun. 6:6757 doi: 10.1038/ncomms7757 (2015).)
이러한 노력의 일환으로 본 연구실에서는 Cryptococcus neoformans의 병원성 조절 신호전달기작을 유전체 수준에서 이해하고 이를 통한 새로운 치료타깃을 발굴하기 위해 신호전달 핵심 인자인 전사조절인자와 인산화효소 변이균주 라이브러리를 구축하여 대용량 기능유전체 연구를 가능하게 하였다. Cryptococcus neoformans 전사조절인자의 경우 세포내 유전자의 발현을 관장하는 155개의 전사조절인자에 대한 총 322개 유전자변이균주를 제조하고 이들에 대한 병원성을 비롯한 30여개의 다양한 형질(생육, 분화, 병원성인자 생성능, 각종 스트레스 반응, 항진균제 저항성, 병원성 등)에 대한 통합적 분석을 실시하여 유전체 수준의 전사조절인자 네트워크를 규명하였다. 이러한 전사인자들은 질병을 일으킬 뿐만 아니라 항진균제 저항에도 관여하는 새로운 전사조절인자들이 존재함을 확인하였고, 진화적으로 독특한 이러한 전사조절인자들이 세포 속 스트레스 조절, 질병유발 및 항진균제 저항에도 관여한다는 사실을 확인하였다.
Cryptococcus neoformans 인산화효소의 경우 진균 세포내에서 다양한 생명현상을 관장하였는데, 전체 발굴한 183개의 인산화효소 중 129개 인산화효소에 대한 총 264개 유전자변이균주를 제조하고 이들에 대한 통합적인 형질분석을 실시하여 유전체 수준의 인산화효소 네트워크를 규명하였다. 병원성 진균 세포 내 단백질의 약 30%의 활성을 조절하는 인산화효소에 대한 기능유전체학적 접근을 통해 병원성 조절 관련 신호전달기작의 분석뿐 아니라 병원균을 조절할 수 있는 새로운 약물타깃을 발굴하였다. 인산화효소는 가장 각광받는 약물개발의 타깃임에도 불구하고, 현재까지 이를 타깃으로 하는 항진균약물은 개발된 바 없어 향후 새로운 차원의 항진균제 개발이 가능할 것으로 예측된다.
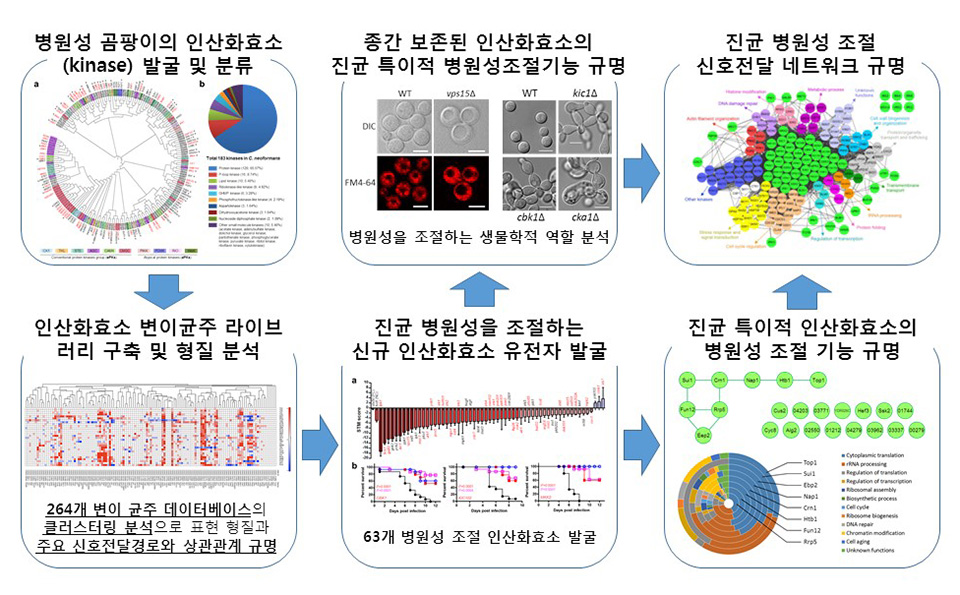
뇌수막염 진균인 크립토코쿠스 네오포만스의 인산화효소 유전자변이균주 라이브러리 제조 및 병원성 조절 신호전달경로 규명
(Lee, K.-T. et al., Systematic functional analysis of kinases in the fungal pathogen Cryptococcus neoformans. Nat. Commun. 7:12766 doi: 10.1038/ncomms12766 (2016).)
이러한 기능유전체 연구는 담자균류 최초로 모든 전사인자와 인산화효소를 대상으로 대용량으로 이루어진 연구이며, 모든 표현형질 데이터는 웹 데이터베이스 기반으로 공개하여 다른 연구자 및 일반인의 접근이 가능하게 하였다(TF: http://tf.cryptococcus.org; Kinase: http://kinase.cryptococcus.org). 새롭게 발견된 병원성 조절 유전자 또는 단백질을 저해하는 물질을 발굴하는 것은 저해 물질 자체의 효과뿐만 아니라 현재 사용되고 있는 항진균제와의 상승작용을 통해 기존 약물 사용량을 현저하게 줄이면서도 항진균 효과를 증진시킬 수 있는 방법을 개발할 수 있는 가능성이 있기에, 진균 대상의 신규 약물개발 스크리닝 시스템을 구축하여 저해 물질 발굴에 이용될 예정이다. 현재 국내외 여러 구조분석 및 약물개발 전문가들과 공동연구를 통해 병원성 조절 신호전달인자의 구조결정 및 타깃약물 개발 후속연구를 진행하고 있다. 또한 병원성 조절 특이적 신호전달기작 규명을 통해 병원성 진균이 인체 내에 감염되어 질병을 일으키고 생명을 위협하는 통합적인 메커니즘을 분석하고, 병원성 진균 특이적인 생체 메커니즘을 규명/활용할 수 있는 다각도의 연구를 진행하고 있다.


